![]() Скачать лекцию «Глаукомная оптическая нейропатия у собак современные аспекты патогенеза, диагностики и лечения»
Скачать лекцию «Глаукомная оптическая нейропатия у собак современные аспекты патогенеза, диагностики и лечения»
![]() Скачать статью «Глаукомная оптическая нейропатия у собак современные аспекты патогенеза, диагностики и лечения»
Скачать статью «Глаукомная оптическая нейропатия у собак современные аспекты патогенеза, диагностики и лечения»
Поражение сетчатки и ЗН на фоне повышенного ВГД — основополагающие факторы развития глаукоматозного процесса. Без понимания сложных механизмов, происходящих в нейронах сетчатки на фоне повышенного офтальмотонуса, адекватное представление о заболевании невозможно, как и выбор эффективных средств лечения. Современные возможности в диагностике ГОН у собак позволяют выявлять патологические изменения в заднем отрезке глаза, прогнозировать развитие патологии и назначать соответствующее лечение.
Ключевые слова: внутриглазное давление, глаукома, нейропатия, сетчатка, собака.
Сокращения: АД — артериальное давление, АТФ— аденозинтрифосфат, АФК — активные формы кислорода, БКК — блокаторы кальциевых каналов, ВГД — внутриглазное давление, ГАМК — гамма-аминомасляная кислота, ГЗН — головка зрительного нерва, ГКС — ганглионарные клетки, ГОН— глаукомная оптическая нейропатия, ЗН — зрительный нерв, ИКА — ингибиторы карбоангидразы, ЛС— лекарственное средство, ОКТ— оптическая когерентная томография, ОП — осцилляторные потенциалы, СЛП— сканирующая лазерная поляриметрия, СНВС — слой нервных волокон сетчатки, ПЭРГ — паттерн-электроретинограмма, УЗИ — ультразвуковое исследование, цАМФ — циклический аденозинмонофосфат, ЦНС — центральная нервная система, ЭРГ — электроретинограмма, BDNF — brainderived neurotrophic factor (нейротрофический фактор мозга), CNTF— сiliary neurotrophic factor (цилиарный нейротрофический фактор), FGF — fibroblast growth factors (фибробластный фактор роста), GDNF — glial cell-derived neurotrophic factor (глиальный нейротрофический фактор), mGlu7— metabotropic glutamate type 7 (метаботропный глутаматный рецептор тип 7), NGF— nerve growth factor (фактор роста нерва), NMDA — N-метил-D-аспартат
Введение
Глаукома на сегодняшний день остается одной из наиболее тяжелых офтальмопатий у животных. Сложность ее лечения у собак обусловлена, в основном, несвоевременным обращением к ветеринарному врачу-офтальмологу. Как правило, у пациентов с глаукомой ВГД значительно повышено, а зрительные функции в полной мере утрачены. Поэтому приходится прибегать к хирургическому лечению запущенного заболевания — энуклеации или протезированию глазного яблока.
Даже если владельцы обращаются за помощью в тот период, когда ВГД поддается медикаментозной коррекции, назначенное лечение не всегда оказывает желаемый результат. Осложняет процесс лечения тот факт, что терапия должна быть регулярной и длительной, однако высокая стоимость противоглаукомных ЛС вынуждает владельцев сократить срок использования препаратов, что сводит к минимуму положительную динамику в лечении [3].
В настоящее время, как в медицине, так и в ветеринарии, глаукому принято интерпретировать как группу хронических глазных заболеваний с различной этиологией, сопровождающихся периодическим или постоянным повышением ВГД с прогрессирующим поражением ЗН и сетчатки, и, как следствие, снижением зрительных функций. Буквально несколько десятилетий назад глаукому характеризовали только как заболевание, сопровождающееся повышением ВГД. Но именно характерные изменения в сетчатке глаза и ЗН в полной мере отражают определение «глаукома» [1,5,6,37].
Анатомия зоны патологического процесса при ГОН
По нашему мнению, представление о патологических процессах в сетчатке ЗН, развивающихся при глаукомном поражении, определяется знанием анатомии тех структур глазного дна, которые подвергаются воздействию повышенного ВГД.
Сетчатка глаза выстилает изнутри всю поверхность сосудистой оболочки и граничит со стекловидным телом. Почти на всем своем протяжении оптическая часть сетчатки состоит из 10 слоев: пигментного, фотосенсорного, наружной пограничной мембраны, наружного зернистого слоя, наружного сплетениевидного слоя, внутреннего зернистого слоя, внутреннего сплетениевидного слоя, ГКС, СНВС, внутренней пограничной мембраны.
При ГОН поражается наиболее глубокий и чувствительный слой сетчатки — ГКС. Аксоны этих клеток образуют СНВС, а затем и сам ЗН, который в области решетчатой пластинки склеры формирует ГЗН — одну из наиболее значимых структур глаза, поражение которой объясняет развитие ГОН.
Кровоснабжение сетчатки осуществляется за счет центральной артерии сетчатки, которая проходит в слое нервных волокон, образуя капиллярную сеть, а также хориокапилляров сосудистой оболочки глаза (рис. 1).
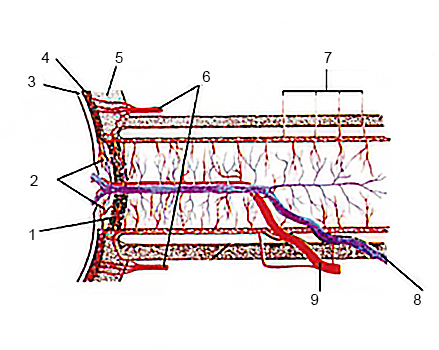
Рисунок 1. Кровоснабжение заднего отрезка глазного яблока. 1 – решетчатая пластинка склеры, 2 – сосудистая часть преламинарной части ДЗН, 3 – сетчатка, 4 – хориоидея, 5 – склера, 6 – задние короткие ресничные артерии, 7 – коллатеральные сосудистые ветви, 8 – центральная вена сетчатки, 9 – центральная артерия сетчатки
Анатомически необходимо рассматривать все элементы глазного дна, как по отдельности, так и в комплексе для понимания развития ГОН.
Необходимо выделить несколько основных анатомических структур глаза, имеющих решающее значение в патогенезе ГОН: ГКС, СНВС, сосуды сетчатки и хориокапиллярное кровоснабжение, ГЗН и решетчатая пластинка.
Патогенез ГОН
Ключ к перспективному лечению глаукомы — это понимание процессов, происходящих в сетчатке и ЗН под воздействием повышенного ВГД (рис. 2). В настоящий момент благодаря широкому выбору ЛС гипотензивная терапия ГОН может быть достаточно эффективной, а новые методы хирургического и лазерного лечения позволяют добиться хороших результатов. Но, к сожалению, даже на глазах со стабилизированным ВГД сетчатка утрачивает свою функциональность, а зрительные функции продолжают снижаться [3,15].
Под ГОН понимают поражение слоя ГКС, сопровождающееся атрофией ЗН и снижением зрительных функций [6,10]. Факторы риска развития ГОН — повышенное ВГД, слабость решетчатой пластинки, нарушение кровоснабжения ГЗН [11,24]. Следует признать, что в данный момент существует такое понятие как «глаукома нормального давления» или «нормотензивная глаукома», характеризующаяся развитием ГОН на фоне нормального ВГД. Поэтому вопрос об однозначной роли офтальмогипертензии в развитии глаукомы остается спорным [15,19,47].
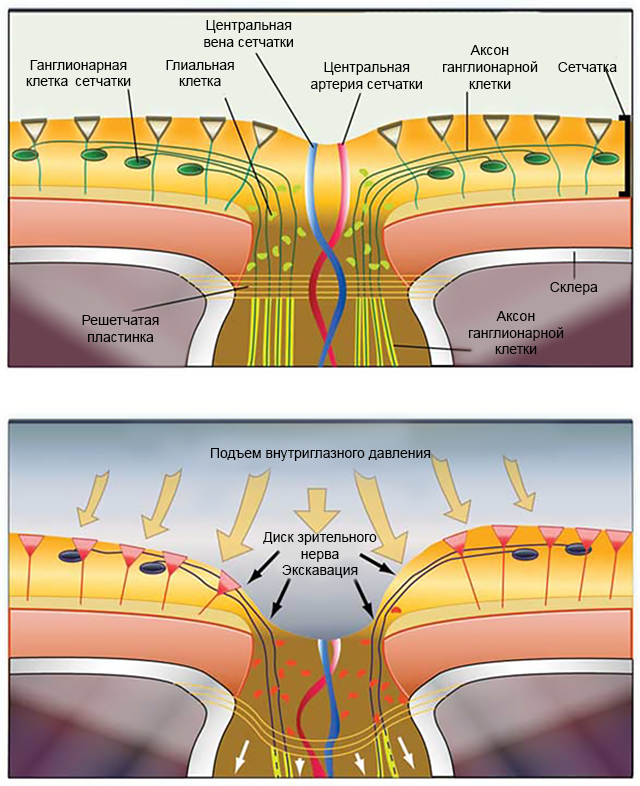
Рисунок 2. Схематическое изображение воздействия ВГД на сетчатку и зрительный нерв
Патогенетический механизм поражения нейроретины и ЗН при глаукоме сводится к совокупности воздействия нескольких основных факторов: биомеханического — прогиба решетчатой пластинки вследствие увеличения ВГД выше толерантного и сдавливание аксональных пучков ЗН в просветах микротубул с нарушением аксонального тока; сосудистого — нарушения микроциркуляции в области ГЗН (вазоспазм, реология, реперфузия, снижение перфузионного давления); метаболического — переизбытка глутамата и свободных радикалов вследствие ишемии, а также усиления перекисного окисления липидов [10,11,24,42,46,49].
Аксональный транспорт нейротрофических факторов обеспечивает рост и функциональность ГКС. Нарушение как ортоградного, так и ретроградного транспорта этих питательных материалов к нейроретине, вследствие сдавливания волокон ЗН при повышении ВГД, приводит к апоптозу клетки. Наиболее активными нейротрофическими факторами, играющими важную роль в защите ГКС и их аксонов, являются: NGF, CNTF, BDNF, FGF, GDNF [29,30,41,45].
Сосудистый фактор, участвующий в развитии ГОН, реализуется сразу через несколько процессов: ишемию, реперфузию, вазоспазм, снижение артериального давления. Кровоснабжение заднего отрезка глаза осуществляется как за счет хориокапилляров, так и центральных сосудов сетчатки. После сдавливания сосудистого пучка в отверстии решетчатой пластинки развивается ишемия сетчатки [12]. Если ВГД колеблется, то восстановление кровообращения после ишемии, или реперфузия, приводит к усиленному высвобождению свободных радикалов и экспрессии металлопротеиназ, что негативно влияет на сетчатку глаза [44]. В последнее время большое внимание уделяется вазоконстрикторному пептиду — эндотолеину-1, который продуцируется клетками сосудистого эндотелия. Значительное содержание этого пептида в плазме крови и внутриглазной жидкости провоцирует развитие вазоспастического синдрома и, как следствие, уменьшение кровотока в ГЗН [6,7,31].
Суть микроциркуляторных расстройств заключается в сужении приводящих артерий и уменьшении перфузионного давления, развитии капиллярного стаза и возникновении гипоксии, запускающей цепь метаболических процессов, ведущих к апоптозу ГКС.
Ключевая роль в развитии ГОН отводится метаболическим реакциям в сетчатке глаза [7]. На сегодняшний день особое значение придают нескольким процессам, протекающим на клеточном уровне: развитию эксайтотоксичности, усиленной продукции свободных радикалов и оксида азота, митохондриальной дисфункции (рис. 3) [35,36].
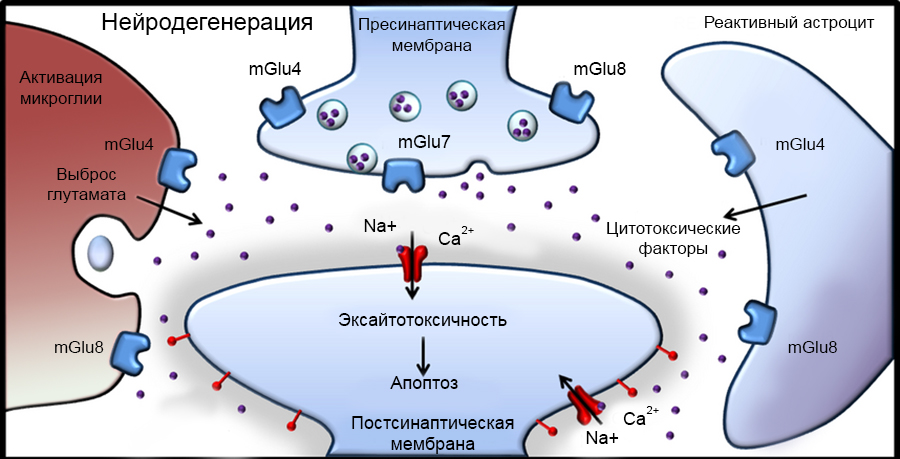
Рисунок 3. Процесс нейродегенерации под воздействием метаболического фактора в нейронах сетчатки.
Феномен глутаматной эксайтотоксичности принято считать наиболее важным метаболическим процессом, приводящим к гибели ГКС [20]. Суть его заключается в нарушении ионного транспорта в ответ на ишемию сетчатки. Пассивный отток K+ из ГКС и приток ионов Ca2+ по кальциевым каналам контролируется рецепторами, которые активируются нейромедиаторами — глутаматом и аспартатом. В результате ишемии и реперфузии происходит активация микроглии и астроцитов, а также повышение содержания глутамата в межклеточном пространстве, что обусловливает перевозбуждение глутаматных (NMDA) рецепторов и проникновение избыточного количества Ca2+ в клетку [6,13,35]. Избыточное содержание Ca2+ внутри клетки активирует внутриклеточные ферменты — липазы, протеазы, эндонуклеазы, что приводит к ферментативной каскадной реакции и, как результат, катаболическому повреждению нейрона [6,7,10,19].
Немаловажное значение в развитии ГОН имеет окислительный стресс. АФК постоянно продуцируются в сетчатке, но при ишемии и гипоксии происходит избыточное выделение супероксида-аниона и гидроксильного радикала митохондриями ГКС, которые в итоге и становятся мишенями АФК. В этом механизме важный элемент — реперфузия, при которой возрастает концентрация кислорода в клетках и в избыточных количествах вырабатываются продукты метаболизма — свободные радикалы. В условиях разрушенной антиоксидантной системы клетка не способна выдержать такую концентрацию АФК и происходит поражение клеточных структур, в первую очередь митохондрий. Снижение поступления в нейроны молекулярного кислорода инициирует процессы перекисного окисления липидов, продукты которых не только повреждают мембраны клеток, но и оказывают вазоконстрикторное действие. Следует напомнить, что процессы свободно-радикального окисления в клетках сетчатки являются частью глутамат-кальциевого каскада [6,7,20,34,36].
Клинические симптомы ГОН и диагностика
Один из наиболее важных вопросов — возможность диагностики ГОН у животных, в частности у собак. На данный момент доступно несколько методов исследования глаза, при которых мы можем регистрировать наличие или отсутствие ГОН у собак с повышенным ВГД. Зная теоретические основы, мы можем выявлять последствия повышенного офтальмотонуса в сетчатке и ЗН.
Основные клинические симптомы ГОН: формирование глаукоматозной экскавации ДЗН, истончение СНВС, нарушение кровоснабжения сетчатки.
Самые удобные и доступные методы исследования сетчатки и ДЗН у животных — офтальмоскопия и фундоскопия, посредством которых врач может оценить изменения структур глазного дна.
При офтальмоскопии важно определить стадию развития глаукоматозного процесса, чтобы сопоставить полученные данные о состоянии глазного дна с тяжестью заболевания. Так, исходя из полученных нами данных, у собак с непродолжительным течением заболевания изменения глазного дна незначительны. На начальном этапе глаукоматозный процесс протекает на клеточном уровне и не сопровождается видимыми офтальмоскопическими и гистоморфологическими изменениями (рис. 4,5). В отдельных случаях у животных с резким подъемом офтальмотонуса может отмечаться сильный отек сетчатки и ДЗН [1,23]. Но прогрессирование глаукомы приводит к дегенеративным процессам в сетчатке и ДЗН, что может быть определено офтальмоскопически уже через 5…7 дней от начала заболевания.
Рисунок 4. Состояние глазного дна собаки с начальной стадией глаукомы.
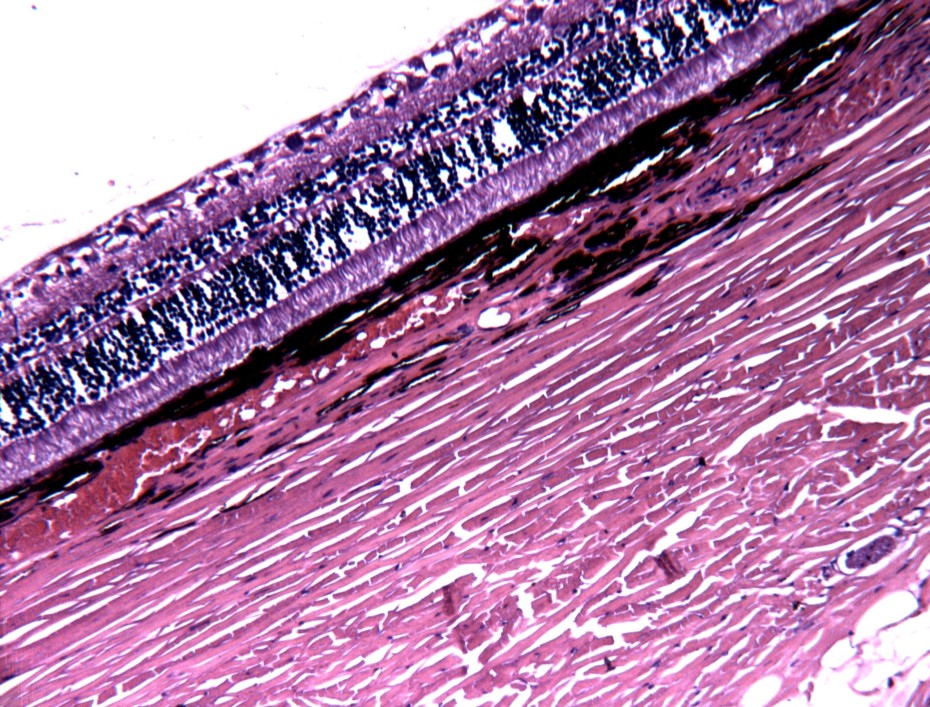
Рисунок 5. Гистологический срез сетчатки глаза собаки с начальной стадией глаукомы.
У собак с продолжительностью заболевания от 5 до 30 дней изменения будут более выраженными, что мы связывали с более длительным воздействием повышенного ВГД на сетчатку и ГЗН. Наблюдают расширение экскавации ДЗН и уменьшение нейроретинального пояска, истончение сосудов сетчатки (больше периферических), появление локальной тапетальной гиперрефлексии (рис. 6) [1,23].
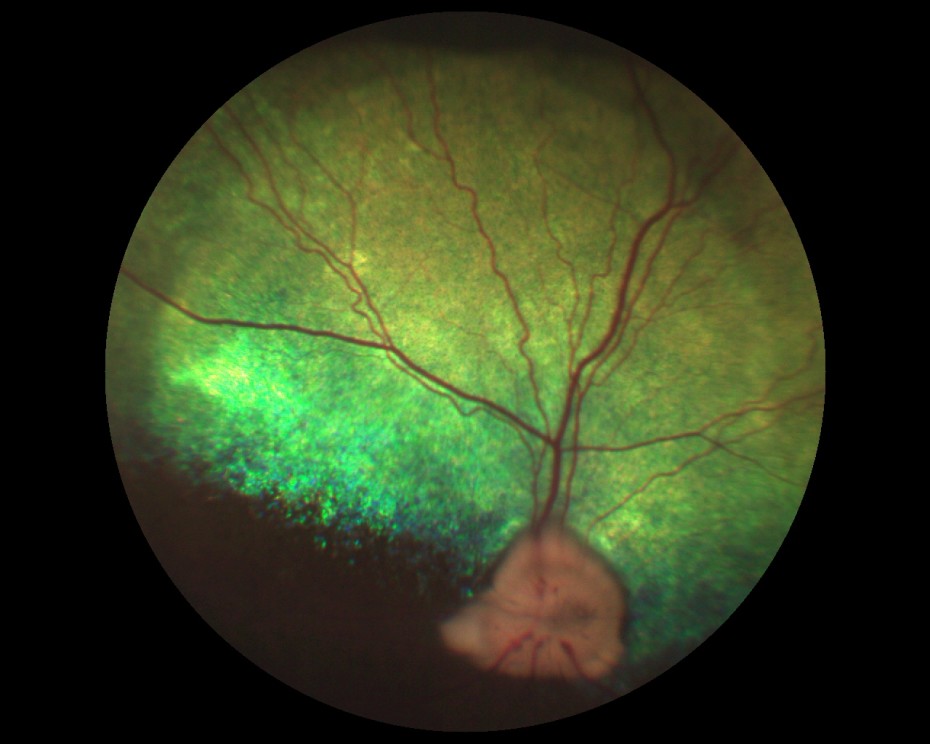
Рисунок 6. Состояние глазного дна собаки с развитой стадией глаукомы.
Морфологические изменения сетчатки характеризовались истончением СНВС и ГКС, а также потерей ядер во внутреннем ядерном слое. В тоже время целостность и организация фоторецепторов сохранялась (рис. 7).
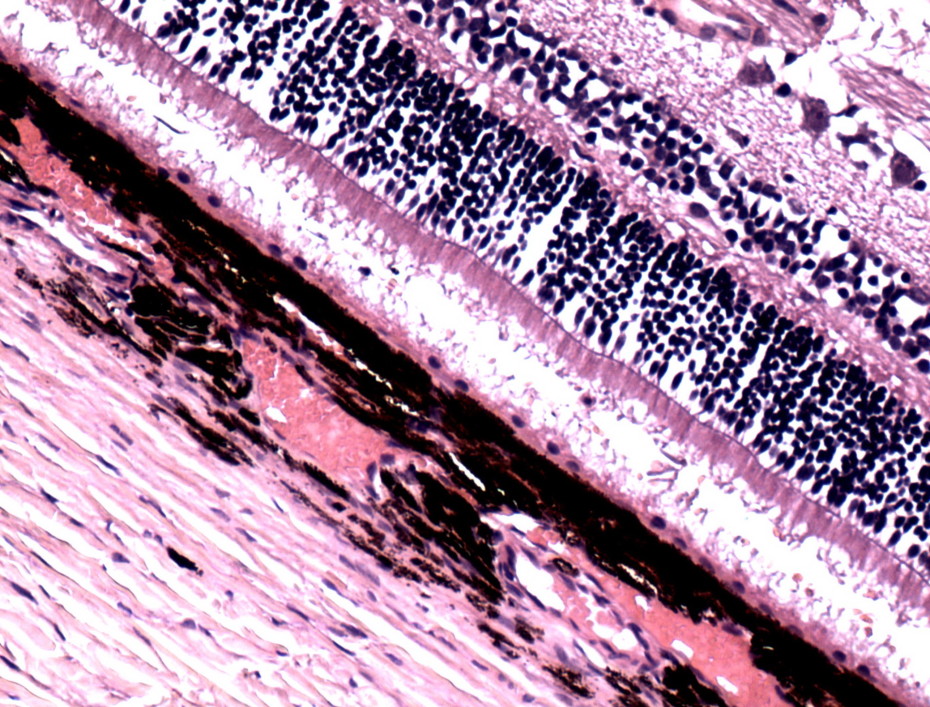
Рисунок 7. Гистологический срез сетчатки глаза собаки с развитой стадией глаукомы.
У собак с продолжительностью заболевания от 1 до 3 мес изменения глазного дна будут наиболее выраженными. По нашему мнению, это связано с длительным воздействием стойкого повышенного офтальмотонуса на сетчатку и ГЗН. Отмечается бледно-серый ДЗН с тотальной экскавацией, исчезновение центральных и периферических сосудов сетчатки, генерализованная гиперрефлексия и гиперпигментация тапетума (рис. 8).
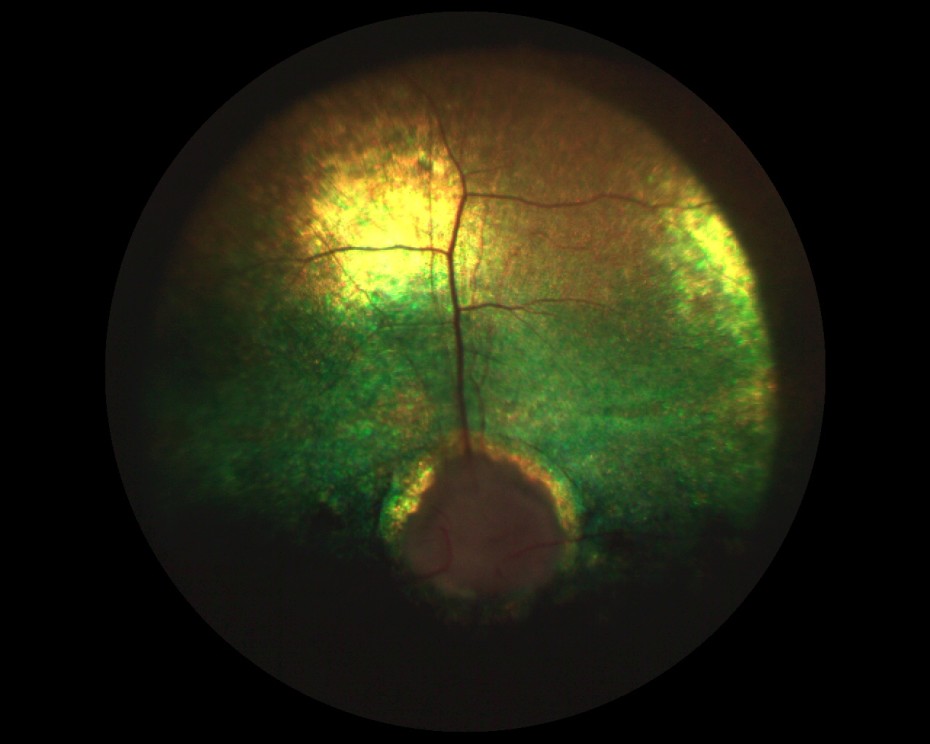
Рисунок 8. Состояние глазного дна собаки с терминальной стадией глаукомы.
Хроническая ишемия нейроретины приводит к грубым структурным изменениям, дезорганизации слоев, гипертрофии пигментного эпителия, атрофии ДЗН, что закономерно обусловливает угнетение зрительных функций [1,23]. Гистологические исследования сетчатки и ДЗН при терминальной стадии глаукомы позволили выявить потерю СНВС и ГКС, очаговую атрофию биполярных клеток и их отростков, а также дезорганизацию фоторецепторов сетчатки (рис. 9).
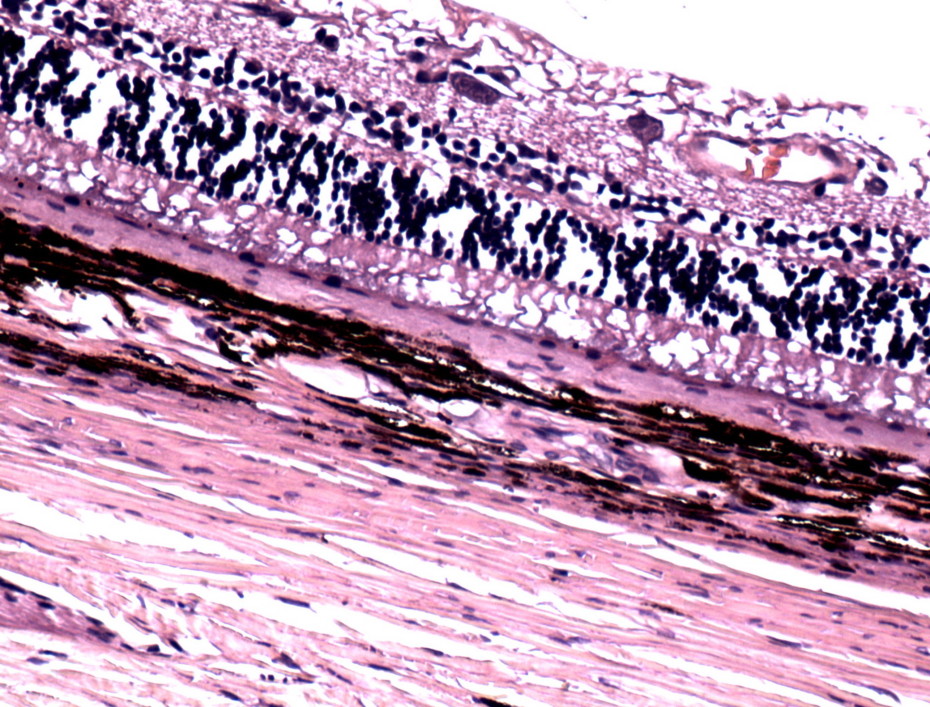
Рисунок 9. Гистологический срез сетчатки глаза собаки с терминальной стадией глаукомы.
При нарушениях прозрачности оптических сред (отек, пигментация и повреждения роговицы, помутнение хрусталика, кровоизлияния в камеры глаза) одним из немногочисленных методов исследования заднего сегмента глаза при глаукоме является УЗИ. На продвинутой стадии глаукоматозного процесса можно визуализировать отчетливую экскавацию ДЗН и исследовать кровообращение заднего отрезка глазного яблока [2,16,22].
Для более качественной оценки зрительных функций при глаукоме у собак используют ЭРГ. Смешанный палочко-колбочковый ответ на световую стимуляцию не всегда дает характерную картину глаукоматозного процесса. Тем не менее, проводя данное исследования на разных стадиях заболевания, можно выявить изменения отдельных компонентов ЭРГ, что будет говорить о прогрессировании глаукомного поражения сетчатки [28].
Так, при начальной стадии глаукомы, когда из всех слоев сетчатки страдает только ГКС, палочки и колбочки продолжают выполнять свою функцию, а соответственно протокол ЭРГ будет нормальным (рис. 10). В некоторых случаях возможна регистрация супернормального ответа на световую стимуляцию, а также незначительное снижение b-волны.
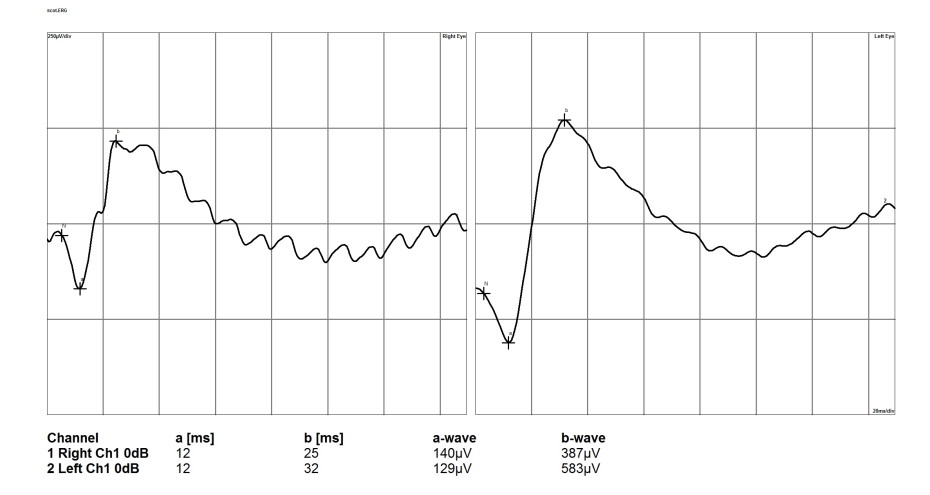
Рисунок 10. Электроретинограмма сетчатки глаза собаки при начальной стадии глаукомы (левый глаз).
При развитой стадии глаукомы у собак регистрируется снижение всех компонентов ЭРГ. Но если изменение амплитуды a-волны будут не значительно выраженными, то амплитуда и латентность b-волны снижается в среднем на 25% (рис. 11). Такое состояние мы связываем с вовлечением в патологический процесс биполярных клеток, а также клеток Мюллера, которые, как известно, участвуют в генерации b-волны. Также, немаловажным фактором обуславливающим снижение b-волны является нарушение кровообращения сетчатки и развитие ишемии.
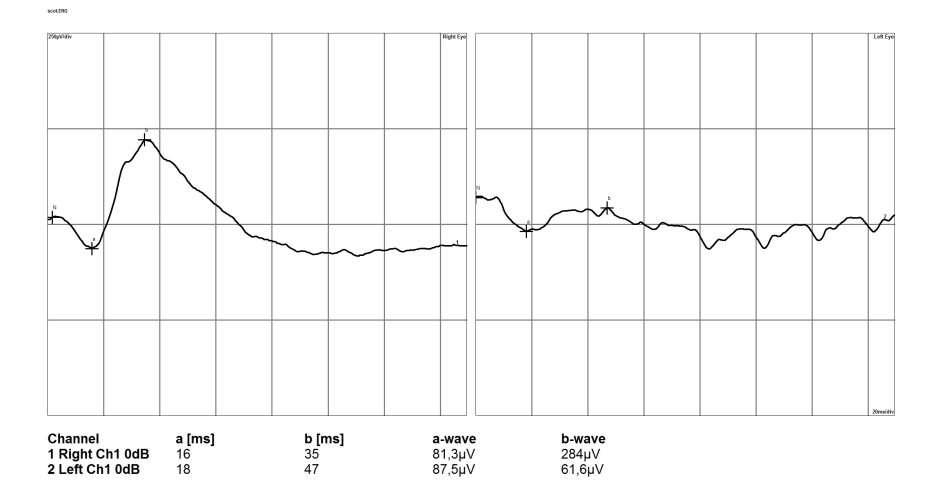
Рисунок 11. Электроретинограмма сетчатки глаза собаки при развитой стадии глаукомы (левый глаз).
В случаях терминальной стадии глаукомы отмечается значительное угнетение a- и b-волн, вплоть до значений изолинии. Это говорит о поражении всех слоёв сетчатки: от фоторецепторов до ГКС (рис. 12).
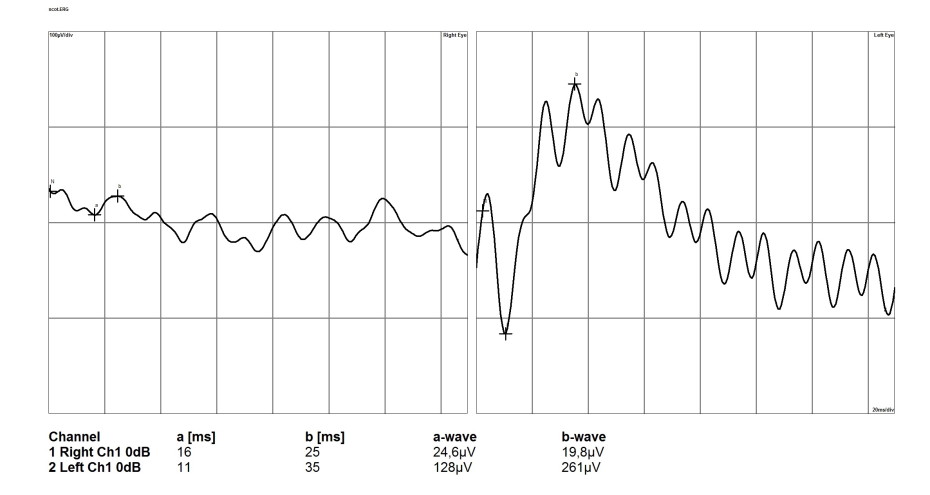
Рисунок 12. Электроретинограмма сетчатки глаза собаки при терминальной стадии глаукомы (правый глаз)
Основная задача врача — диагностировать ГОН на ранних этапах, для чего необходимо использовать специфические виды ЭРГ, например, ПЭРГ. Этот метод технически более сложен, чем обычная ЭРГ, особенно у животных. Клинически доказано, что ПЭРГ отражает активность внутренних слоев сетчатки. При начальном глаукоматозном процессе, когда отмечают изменения пространственной контрастной чувствительности, на фоне нормальной общей ЭРГ отмечено снижение паттерн-электроретинограммы. При глаукоме изменения, обнаруженные посредством ПЭРГ, отмечают до появления аномалий на ДЗН и сетчатке [26,40].
Высокочувствительными, но слабо специфичными для диагностики глаукомы являются ОП, характер которых зависит от ретинального кровотока и снижается у собак с повышенным ВГД еще до того, как начинают выявляться значительные изменения на глазном дне [14].
На данный момент самыми совершенными методами исследования сетчатки являются ОКТ и СЛП. В ветеринарной практике такие исследования проводят только в современных зарубежных центрах из-за высокой стоимости оборудования. Тем не менее, информативность и точность ОКТ и СЛП сложно переоценить.
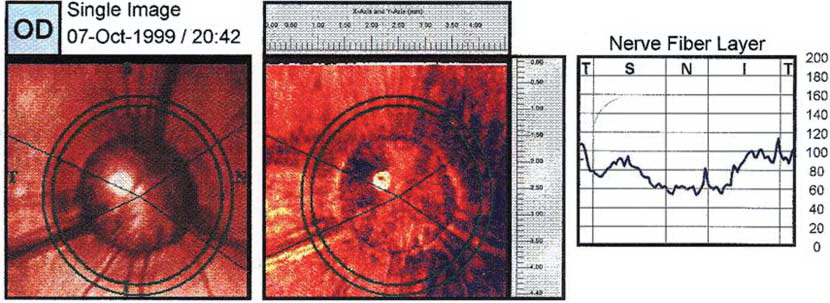
Рисунок 13. Изображение глаукоматозного глаза собаки, полученное при СЛП. Nerve Fiber Layer – слой нервных волокон. [21]
В основе ОКТ лежит измерение времени задержки светового луча, отраженного от исследуемой ткани. Источником излучения в современных приборах ОКТ служит широкополосный суперлюминесцентный светодиод. В ходе исследования световой импульс делится надвое, при этом одна его часть отражается от исследуемого объекта, а другая (контрольная), от специального отражающего зеркала. Затем прибор суммирует отраженные сигналы, что вызывает эффект интерференции. Полученная информация обрабатывается с помощью сложного математического алгоритма и формируется так называемый скан исследуемой области, который, по аналогии с УЗИ, получил название А-скана. Столь высокое пространственное разрешение ОКТ дает возможность фактически проводить прижизненную микроскопию исследуемой ткани (рис. 14).
Рисунок 14. Изображение, полученное при ОКТ нормального глазного дна собаки (сверху) и глазного дна при глаукоме (снизу). [23,24]
Лечение и профилактика ГОН
Как показывают многочисленные исследования, эффективное снижение ВГД не гарантирует сохранность зрительных функций сетчатки [3,15,19]. Нормализация офтальмотонуса после его подъема может заставить врача-офтальмолога надеяться на благоприятный исход заболевания, в то время как метаболические изменения, обусловленные ишемией сетчатки, будут прогрессировать, что приведет атрофии ЗН и потере зрения. Очевидно, что стратегия лечения глаукомы у собак, направленная на нормализацию только ВГД, не дает желаемого эффекта и не гарантирует сохранение функциональности сетчатки. Наиболее перспективное направление — нейропротекция, обеспечивающая защиту нейронов от повреждающих факторов и предотвращение каскада реакций, вызывающих поражение СНВС, улучшающая трофику тканей и местную микроциркуляцию, а также основное и коллатеральное кровообращение.
Нейропротекторную терапию ГОН следует назначать, когда поражение нервной ткани еще не стало необратимым (сохранность зрительных функций подтверждена), а также при стабилизации ВГД.
В нейропротекции принято различать прямое и опосредованное действие ЛС. Прямые нейропротекторы подразделяют на первичные (действие направлено на прерывание ранних процессов ишемического каскада) и вторичные (прерывание отсроченных механизмов гибели нейронов).
К первичным прямым нейропротекторным ЛС относят препараты, блокирующие NMDA-рецепторы, ингибиторы синтеза пресинаптического высвобождения глутамата. Следует отметить, что первичные нейропротекторы оказывают выраженное побочное действие на ЦНС, что ограничивает их применение.
К антагонистам глутаматных (NMDA) рецепторов относят такие препараты, как элипродил, мемантин, лубелузол. Мемантин — наиболее перспективное ЛС, так как при его применении в малых дозах побочное действие на ЦНС наименее выражено. Этот неконкурентный антагонист глутаматных (NMDA) рецепторов тормозит глутаматергическую нейротрансмиссию и прогрессирование нейродегенеративных процессов, оказывает нейромодулирующее действие.
Также к препаратам блокирующим NMDA-рецепторы относят магнезию. Ионы Mg2 блокируют NMDA-ассоциированные каналы потенциал зависимым способом, но электрофизиологически внеклеточный магний ведет себя как неконкурентный антагонист NMDA-рецепторов.
Глицин — еще один первичный нейропротектор; это активатор тормозной нейротрансмиссии, тормозит передачу импульсов на NMDA-рецепторы в условиях их перевозбуждения при ишемии. Связываясь с глициновыми рецепторами, оказывает «тормозящее» воздействие на нейроны, уменьшает выделение из нейронов «возбуждающих» аминокислот, таких, как глутаминовая кислота, и повышает выделение ГАМК. Помимо прочего, глицин обладает общеметаболическим, ноотропным и антистрессовым действием, что, при его минимальных побочных эффектах, позволяет рассматривать его как препарат выбора при лечении ГОН у собак.
Сегодня доказано, что прямым нейропротективным действием обладают БКК, к которым относят амлодипин, верапамил, нифедепин. Так, БКК блокируют кальциевые каналы пресинаптической мембраны, препятствуют избыточному входу ионов кальция внутрь терминали аксона и избыточному выбросу нейромедиатора глутамата в синаптическую щель, а также снижают сосудистое сопротивление в артериях сетчатки. Препараты группы БКК сегодня широко известны в ветеринарной кардиологической и неврологической практике. Отрицательная сторона лечения препаратами данной группы, — наличие побочных эффектов, связанных со снижением АД у животных.
ЛС, воздействие которых осуществляется на отсроченные механизмы гибели нейронов, называют вторичными нейропротекторами. К ним относят антиоксиданты, пептидные биорегуляторы. Преимущество данного направления нейропротекторной терапии — незначительные побочные эффекты и комплексное действие.
Антиоксидантная терапия с применением таких препаратов, как мексидол, эмоксипин, рексод-оф, гистохром, визомитин оказывает поликомпонентное действие, включающее в себя угнетение процессов свободно-радикального окисления внутри клетки; ингибирование процессов перекисного окисления липидов; активное взаимодействие с первичными и гидроксильными радикалами; снижение повышенного уровня оксида азота; ингибирование кальций-независимой фосфодиэстеразы, вследствие чего повышается концентрация цАМФ в тканях; торможение гликолитического процесса [3,5,6].
Отмечено благоприятное действие антиоксидантов на реологические свойства крови.
К группе пептидных биорегуляторов, применяемых для нейропротекции при ГОН, относятся препараты кортексин и ретиналамин, оказывающие нейропротекторное и нейротрофическое действие. Кортексин повышает содержание АТФ в нейронах, активирует метохондриальную активность. Ретиналамин, выделенный из сетчатки крупного рогатого скота, осуществляет коррекцию метаболизма и предотвращает окислительный стресс и эксайтотоксичность, усиливает активность мюллеровских клеток.
Защита сетчатки от повреждающих факторов при глаукоме может быть также реализована через различные механизмы, присущие противоглаукомным препаратам, что является важным аспектом в лечении ГОН у собак [33,43]. Так, экспериментально доказано, что бримонидин обладает прямым нейропротекторным действием, которое заключается в блокаде поступления ионов Са2+ в нервную клетку, вследствие чего повышается ее жизнедеятельность в условиях транзиторной ишемии; торможении высвобождения аспартата и глутамата нервной клеткой, что препятствует ее апоптозу; стимуляции синтеза нейротрофических факторов в сетчатке глаза, что повышает жизнеспособность фоторецепторов и ГКС; сохранении и улучшении офтальмогемодинамики за счет увеличения ретинального капиллярного кровотока [4,17,32].
Бетаксолол при местном применении обеспечивает защиту нейронов и ГКС от повреждающих факторов путем прямой блокады Са- и Na-каналов и уменьшения поступления ионов Са2+ в ГКС. Кроме того, он снижает чувствительность NMDA-рецепторов ГКС к глутамату [4,8,9].
ИКА (дорзоламид, бринзоламид) улучшают глазничный кровоток, в том числе ДЗН, оказывают вазодилатирующий эффект, а также показатели глазного пульса [4,18].
Заключение
В заключении хотелось бы отметить, что лечение глаукомы у собак на сегодняшний день может быть достаточно успешным. Широкий выбор гипотензивных ЛС, разработка и внедрение эффективных методов хирургического и лазерного лечения, в противовес энуклеации и протезированию глазного яблока, позволяет говорить о значительных перспективах в лечении глаукомы. Но, невозможно ограничиваться только достижением гипотензивного эффекта. Понимание патогенетических процессов происходящих в сетчатке и ЗН при повышении ВГД, позволяет значительно расширить понимание глаукоматозного поражения. Так, диагностический арсенал, применяемый при диагностике глаукомы, может быть существенно расширен, а методы нейропротекторного лечения ГОН позволяют надеяться, что нейропротекция займет достойное место в лечении глаукомы у животных.
Библиография
- Бояринов, С.А. Офтальмоскопическая картина сетчатки и диска зрительного нерва у собак с глаукомой / С.А. Бояринов // РВЖ.МДЖ. ― ― №3. ― С. 16–18.
- Бояринов, С.А. Применение ультразвукового метода исследования в диагностике вторичной глаукомы у собак / С.А. Бояринов // Ветеринария, зоотехния, биотехнология. — 2015. — №10. — С. 6–12.
- Бояринов, С.А. Современный подход к лечению вторичной глаукомы у собак и кошек / С.А. Бояринов // РВЖ.МДЖ. ― ― №6. ― С. 32–35.
- Бояринов, С.А. Сравнительная эффективность местной гипотензивной терапии глаукомы на фоне хронического воспаления сосудистой оболочки глаза у собак. С.А. Бояринов // РВЖ.МДЖ. ― ― №6. ― С. 9–13.
- Глаукома. Национальное руководство / Под ред. Е.А. Егорова. ― М.: ГЭОТАР-Медиа, 2013. ― 824 с.
- Курышева, Н.И. Глаукомная оптическая нейропатия / Н.И. Курышева. ― М.: МЕДпресс-информ, 2006. ― 136 с.
- Курышева, Н.И. Метаболическая концепция патогенеза глаукоматозной оптической нейропатии / Н.И. Курышева, Н.А. Маркичева, А.И. Деев, Г.А. Шилкин // Материалы науч.-практ. конф. «Современные технологии лечения глаукомы. ― М., 2003. ― С. 87‒96.
- Baptiste, D.C. Comparison of the neuroprotective effects of adrenoceptor drugs in retinal cell culture and intact retina. D.C. Baptiste, A.T. Hartwick, C.A. Jollimore, W.H. Baldridge, B.C. Chauhan, F. Tremblay, M.E. Kelly // Investigative Ophthalmology and Visual Science. —2002 Aug. — No. 43(8). — P. 2666‒2676.
- Brooks, A.M. Ocular beta-blockers in glaucoma management. Clinical pharmacological aspects / A.M. Brooks, W.E. Gillies // Drugs and Aging. —1992. — No. 2(3). — P. 208‒221.
- Brooks, D.E.,Komaromy AM, Kallberg ME. Comparative optic nerve physiology: implications for glaucoma, neuroprotection, and neuroregulation /E. Brooks, A.M. Komaromy, M.E. Kallberg. // Veterinary Ophthalmology — 1999; — No. 2. —P. 13–25.
- Brooks, D.E. Morphologic changes in the lamina cribrosa of beagles with primary open-angle glaucoma / D.E. Brooks, D.A. Samuelson, K.N. Gelatt, P.J. Smith // American Journal of Veterinary Research. ― 1986 Jun. ― No. 50(6). ― P. 936‒941. Староват источник
- Brooks, D.E. Ultrastructural changes in laminar optic nerve capillaries of beagles with primary open-angle glaucoma / D.E. Brooks, D.A. Samuelson, K.N. Gelatt // American Journal of Veterinary Research. ― 1989 Jun. ― No. 50(6). ― P. 929‒935.
- Brooks, D.E. Vitreous body glutamate concentration in dogs with glaucoma / D.E. Brooks, G.A. Garcia, E.B. Dreyer, D. Zurakowski, R.E. Franco-Bourland // American Journal of Veterinary Research. ― 1997 Aug. ― No. 58(8). ― P. 864‒867.
- Brooks, D.E. Changes in oscillatory potentials of the canine electroretinogram during acute sequential elevations in intraocular pressure / D.E. Brooks, Sims M.H., Gum G.G., Blackstock M.J. // Progress in Veterinary and Comparative Ophthalmology. — 1992. — No. 2. — P. 80–89.
- Brubaker, R.F. Delayed functional loss in glaucoma / R.F. Brubaker // American Journal of Ophthalmology. — 1996 May. — No. 121(5). — P. 473‒483.
- Cottrill, N.B. Ultrasonographic and biometric evaluation of the eye and orbit of dogs / N.B. Cottrill, W.J. Banks, R.D .Pechman // American Journal of Veterinary Reseach. ― 1989. — No. 50 (6). — P. 898–903.
- Cvetkovic, R.S. Brinzolamide: a review of its use in the management of primary open-angle glaucoma and ocular hypertension / R.S. Cvetkovic, C.M. Perry // Drugs and Aging 2003. — No. 20(12). — P. 919‒947.
- De Santis, L. Preclinical overview of brinzolamide / L. De Santis // Survey of Ophthalmology. — 2000 Jan. — 44 Suppl 2. —P. 119‒129.
- Fechtner, R.D. Mechanisms of optic nerve damage in primary open angle glaucoma / R.D. Fechtner, R.N. Weinreb // Survey of Ophthalmology. — 1994 Jul-Aug. — No. 39(1). — P. 23‒42.
- Franco-Bourland, R.E. Retinal vulnerability to glutamate excitotoxicity in canine glaucoma: induction of neuronal nitric oxide synthase in retinal ganglion cells / R.E. Franco-Bourland, G. Guízar-Sahagún, G.A. García, A. Odor-Morales, A. Alvarez, F. Esquivel, S. Rodríguez // Proceedings of the Western Pharmacology Society. — 1998. — No. 41. — P. 201‒204.
- García-Sánchez, G.A. Measurement of retinal nerve fiber layer thickness in normal and glaucomatous Cocker Spaniels by scanning laser polarimetry / G.A. García-Sánchez, F. Gil-Carrasco, J.J. Román, D.E. Brooks, A. Alvarez-Clau, G. Hosgood, S. Iwabe, N.A. Moreno-Mendoza // Veterinary Ophthalmology. — 2007 Nov-Dec. — No.10. — Suppl. 1. — P. 78‒87.
- Gelatt-Nicholson, K.J. Comparative Doppler imaging of the ophthalmic vasculature in normal Beagles and Beagles with inherited primary open-angle glaucoma / K.J. Gelatt-Nicholson, K.N. Gelatt, E.O. MacKay, D.E. Brooks, S.M. Newell // Veterinary Ophthalmology. — 1999. — No. 2(2). — P. 97‒105.
- Grozdanic, S.D. Recovery of canine retina and optic nerve function after acute elevation of intraocular pressure: implications for canine glaucoma treatment / S.D. Grozdanic, M. Matic, D.M. Betts, D.S. Sakaguchi, R.H. Kardon // Veterinary Ophthalmology. ― 2007 Nov-Dec. ― No. 10, ― Suppl. 1. ― P. 101‒107.
- Grozdanic, S.D. Functional and structural changes in a canine model of hereditary primary angle-closure glaucoma / S.D. Grozdanic, H. Kecova, M.M. Harper, W. Nilaweera, M.H. Kuehn, R.H. Kardon // Investigative Ophthalmology and Visual Science. ― 2010 Jan. ― No. 51(1). ― P. 255‒263.
- Gupta, P.K. Differentiating glaucomatous from non-glaucomatous optic nerve cupping by optical coherence tomography / P.K. Gupta, S. Asrani, S.F Freedman, M. El-Dairi, M.T. Bhatti // The Open Neurology Journal. — 2011 Jan. — No. 26 (5). — P. 1‒7.
- Hamor, R.E. Evaluation of short-term increased intraocular pressure on flash- and pattern-generated electroretinograms of dogs / R.E. Hamor, P.A.Jr. Gerding, D.T. Ramsey, H.E. Whiteley, G.J Benson., D.J. Schaeffer // American Journal of Veterinary Research. — 2000 Sep. — No. 61(9). — P. 1087‒1091.
- Hernandez-Merino, E. Spectral domain optical coherence tomography (SD-OCT) assessment of the healthy female canine retina and optic nerve / E. Hernandez-Merino, H. Kecova, S.J. Jacobson, K.N. Hamouche, R.N. Nzokwe, S.D. Grozdanic // Veterinary Ophthalmology. — 2011 Nov. — No. 14(6). — P. 400‒405.
- Howard, D.R. Electroretinography of acute hypoxic and increased intraocular pressure status in the dog / D.R. Howard, D.C. Sawyer // American Journal of Veterinary Research. — 1975 Jan. — No. 36(1). — P. 81‒84.
- Iwabe, S. Retrograde axonal transport obstruction of brain-derived neurotrophic factor (BDNF) and its TrkB receptor in the retina and optic nerve of American Cocker Spaniel dogs with spontaneous glaucoma / S. Iwabe, N.A. Moreno-Mendoza, F. Trigo-Tavera, C. Crowder, G.A. García-Sánchez // Veterinary Ophthalmology. — 2007 Nov-Dec. — No. 10. — Suppl. 1. — P. 12‒19.
- Jiang, B. Neuroinflammation in advanced canine glaucoma / B. Jiang, M.M. Harper, H. Kecova, G. Adamus, R.H. Kardon, S.D. Grozdanic, M.H. Kuehn // Molecular Vision. — 2010 Oct. — Vol.15. — No.16. — P. 2092‒2108.
- Källberg, M.E. Endothelin-1, nitric oxide, and glutamate in the normal and glaucomatous dog eye / M.E. Källberg, D.E. Brooks, K.N. Gelatt, G.A. Garcia-Sanchez, N.J. Szabo, G.N. Lambrou // Veterinary Ophthalmology. — 2007 Nov-Dec. — No.10. — Suppl. 1. — P. 46‒52.
- Lee, K.Y. Brimonidine is neuroprotective against glutamate-induced neurotoxicity, oxidative stress, and hypoxia in purified rat retinal ganglion cells / K.Y. Lee, M. Nakayama, M. Aihara, Y.N. Chen, M. Araie // Molecular Vision. — 2010. — No. 16. — P. 246–251.
- Lim, K.S. Mechanism of action of bimatoprost, latanoprost, and travoprost in healthy subjects. A crossover study / K.S. Lim, C.B. Nau, M.M. O’Byrne, D.O. Hodge, C.B. Toris, J.W. McLaren, D.H. Johnson // Ophthalmology. — 2008 May. — No. 115(5). — P. 790‒795.
- Madl, J.E. Depletion of taurine and glutamate from damaged photoreceptors in the retinas of dogs with primary glaucoma / J.E. Madl, T.R. McIlnay, C.C. Powell, J.R. Gionfriddo // American Journal of Veterinary Research. — 2005 May. — No. 66(5). — P. 791‒799.
- McIlnay, T.R. Evaluation of glutamate loss from damaged retinal cells of dogs with primary glaucoma / T.R. McIlnay, J.R. Gionfriddo, R.R. Dubielzig, C.C. Powell, J.E. Madl // American Journal of Veterinary Research. — 2004 Jun. — No. 65(6). — P. 776‒786.
- Neufeld, A.H. Loss of retinal ganglion cells following retinal ischemia: the role of inducible nitric oxide synthase / A.H. Neufeld, Si. Kawai, S. Das, S. Vora, E. Gachie, J.R. Connor, P.T. Manning // Experimental Eye Research. — 2002 Nov. — No. 75(5). — P. 521‒528.
- Ofri, R. Light at the end of the tunnel? Advances in the understanding and treatment of glaucoma and inherited retinal degeneration / R. Ofri, K. Narfstrom // Veterinary Journal. ― 1997. ― No. 174. ― P. 10‒22.
- Ofri, R. Chronic ocular hypertension alters local retinal responsiveness / R. Ofri, W.W. Dawson, K. Foli, K.N. Gelatt // The British Journal of Ophthalmology. — 1993. — No. 77. — P. 502‒508.
- Ofri, R. Primary open angle glaucoma alters retinal recovery from a thiobarbiturate: spatial frequency dependence / R. Ofri, W.W. Dawson, K. Foli, K.N. Gelatt // Experimental Eye Research. — 1993. — No. 56. — P. 481‒488.
- Ofri, R. Visual resolution in normal and glaucomatous dogs determined by pattern electroretinogram / R. Ofri, W.W. Dawson, K.N. Gelatt // Progress in Veterinary and Comparative Ophthalmology. — 1993. — No. 3. — P. 111‒116.
- Samuelson, D.A. Orthograde rapid axoplasmic transport and ultrastructural changes of the optic nerve. Part 2. Beagles with primary open angle glaucoma / D.A Samuelson., L.W. Williams, K.N. Gelatt // Glaucoma. — 1983. — No. 5. — P. 174–184.
- Scott, E.M. Early histopathologic changes in the retina and optic nerve in canine primary angle-closure glaucoma / E.M. Scott, N. Boursiquot, W.A. Beltran, R.R. Dubielzig // Veterinary Ophthalmology. — 2013 Jul. — No. 16. — Suppl. 1. — P. 79‒86.
- Shih, G.C. Secondary neuroprotective effects of hypotensive drugs and potential mechanisms of action / G.C. Shih, D.J. Calkins // Expert Review of Ophthalmology. — 2012 Apr. — No. 7(2). — P. 161–175.
- Weinstein, W.L. Identification of ocular matrix metalloproteinases present within the aqueous humor and iridocorneal drainage angle tissue of normal and glaucomatous canine eyes / W.L. Weinstein, U.M. Dietrich, J.S. Sapienza, K.P. Carmichael, P.A. Moore, T.M. Krunkosky // Veterinary Ophthalmology. — 2007 Nov-Dec. — No. 10. — Suppl. 1. — P. 108‒116.
- Williams, L.W. Orthograde rapid axoplasmic transport and ultrastructural changes of the optic nerve. Part 1. Normotensive and acute ocular hypertensive beagles / L.W. Williams, K.N. Gelatt, G.G. Gum // Glaucoma. — 1983. — No. 5. — P. 117–128.
- Whiteman, A.L. Morphologic features of degeneration and cell death in the neurosensory retina in dogs with primary angle-closure glaucoma / A.L. Whiteman, G. Klauss, P.E. Miller, R.R. Dubielzig // American Journal of Veterinary Research. — 2002 Feb. — No. 63(2). — P. 257‒261.
- Wollstein, G. Retinal nerve fibre layer and visual function loss in glaucoma: the tipping point / G. Wollstein, L. Kagemann, R.A. Bilonick, H. Ishikawa, L.S. Folio, M.L. Gabriele, A.K. Ungar, J.S. Duker, J.G. Fujimoto, J.S. Schuman // The British Journal of Ophthalmology. — 2012 Jan. — No. 96(1). — P. 47‒52.
Summary
S.A. Boyarinov
Glaucomatous optic neuropathy in dogs: modern aspects of pathogenesis, diagnosis and treatment. The affection of the retina and optic nerve as a result of high intraocular pressure is a fundamental aspect in the development of glaucomatous process. Understanding the complex mechanisms occurring in the neurons of the retina against the backdrop of increased intraocular pressure allows to study the problems of the disease more deeply and thoroughly. Modern facilities in the diagnosis of glaucomatous optic neuropathy in dogs allow to identify the lesions in the posterior segment of the eye and predict the further development of the pathology which let us treat it appropriately.
Keywords: intraocular pressure, glaucoma, neuropathy, retina, dog.

